Un coefficiente di rischio per la demenza da radiazioni
DOI: 10.4236/aad.2018.72002 PDF HTML XML
Share and Cite:
La discussione sugli effetti sulla salute delle radiazioni ionizzanti (IR) si è concentrata, fino a poco tempo fa, sul cancro e sui danni genetici, valutati in gran parte attraverso il concetto di "dose assorbita" e i tassi di malattia e gli effetti congeniti rivelati dallo studio giapponese Life Span Study (LSS) dei sopravvissuti alle bombe di Hiroshima e Nagasaki. In effetti, il rischio di cancro e il rischio genetico per dose unitaria attualmente accettato dai governi, in seguito ai consigli delle agenzie per il rischio da radiazioni come la Commissione Internazionale per la Protezione Radiologica (ICRP), si basa in gran parte sulla LSS [1]. Le conclusioni e la sicurezza degli studi sulla LSS saranno qui riesaminate. Tuttavia, è sempre più chiaro che le esposizioni all'IR causano malattie cardiache e una vasta gamma di altre condizioni. In effetti, si sono accumulate prove del fatto che l'IR ha un impatto sulla maggior parte degli organi e dei sistemi del corpo attraverso quello che può essere ampiamente descritto come "invecchiamento precoce" [2]. Una delle condizioni più gravi e legate all'età, che si riscontra sempre più spesso nelle popolazioni umane, è la demenza. La demenza è oggi la quarta causa di morte negli Stati Uniti, e la componente principale della demenza è il morbo di Alzheimer [3]. Ci sono ora notevoli prove che l'esposizione alle radiazioni ionizzanti può portare allo sviluppo del morbo di Alzheimer e alla demenza [4]. Le prove includono i risultati della radioterapia ad alte dosi per i tumori cerebrali [5] [6] [7], ma anche le esposizioni a basse dosi provenienti, ad esempio, da TAC e da studi sui lavoratori del settore nucleare, che saranno discussi di seguito. La questione del nesso di causalità e il rischio di demenza da IR sono qui affrontati attraverso una considerazione di meccanismi, prove di laboratorio ed epidemiologiche, utilizzando la filosofia del nesso di causalità come presentata dal classico lavoro di Mill [8] e Bradford Hill [9].
L'epidemiologia dell'IR e della salute, presentata dalle agenzie di rischio, raramente discute le basi filosofiche su cui vengono tratte le loro conclusioni, anche se le analisi matematiche utilizzate per ridurre l'evidenza a coefficienti di rischio possono essere incredibilmente complesse e scoraggianti, il che conferisce una sorta di credibilità spuria alle conclusioni. I tentativi di torturare le funzioni matematiche di rischio per adattare i dati degli studi LSS possono essere visti nell'approccio del rapporto statunitense BEIR VII [10]. L'ICRP è più modesto nei suoi approcci e si basa generalmente sulla valutazione del rischio attraverso l'assunzione di una funzione lineare senza soglia (LNT) per la risposta alla dose [1] in cui il raddoppio della dose raddoppia il rischio su tutta la gamma di dosi da zero a quelle che causano la morte rapida dell'individuo. Questo approccio continua ad essere applicato nonostante la natura chiaramente complessa dei dati, che generalmente mostra un rischio proporzionato maggiore a basse dosi rispetto alle alte dosi per quasi tutti i tipi di cancro [11] e l'evidente impossibilità di un effetto lineare quando alle alte dosi c'è la morte sia dei tessuti che dell'individuo. Si presume che gli effetti genetici dell'IR siano assenti nell'uomo, nonostante gli studi sugli animali ne dimostrino chiaramente l'esistenza. Anche questo risultato dello studio LSS, che ha implicazioni per la discussione sulla demenza, sarà rivisto. Era singolare che la scoperta dell'assenza di rischio genetico non abbia indotto gli epidemiologi della LSS a esaminare più da vicino i loro protocolli, i presupposti e le attività.
Prima di passare all'IR e alla demenza, può essere utile iniziare con una breve descrizione dell'approccio adottato per valutare il nesso di causalità. La questione della causalità e delle prove è stata notoriamente esaminata per la prima volta circa 150 anni fa dal filosofo John Stuart Mill e descritta in quelli che sono diventati i cosiddetti canoni di Mill [8]. Essi possono essere utilmente applicati agli effetti sulla salute e in effetti lo furono, negli anni '60, dall'epidemiologo britannico Bradford Hill, il cui approccio alla causalità nella salute ambientale è oggi il modello classico [9].Mill ha fornito cinque test per la determinazione del nesso di causalità. Questi erano:
1) Il Canone d'accordo, che afferma che qualsiasi cosa ci sia in comune tra le condizioni antecedenti di un fenomeno può essere supposta essere la causa, o collegata alla causa, del fenomeno;
2) il Canone della differenza, che stabilisce che la differenza tra le condizioni in cui un effetto si verifica e quelle in cui non deve essere la causa o la relazione con la causa di tale effetto;
3) Il Principio dell'accumulazione, che afferma che le conoscenze scientifiche crescono ulteriormente con la scoperta di leggi indipendenti;
4) Il Principio della Conferma del Tribunale, secondo il quale il grado di fiducia nella verità di una legge è proporzionale al numero di istanze favorevoli della legge;
5) La plausibilità di un meccanismo.
Questi sono i metodi fondamentali della scienza [12].
L'applicazione di questo approccio alla causalità nel campo dell'epidemiologia è stata portata avanti da Bradford Hill negli anni Cinquanta. L'autorevole libro Principles of Medical Statistics (Principi della statistica medica) di Hill descriveva quelli che oggi vengono chiamati "i canoni di Hill" e che vengono insegnati a tutti i medici e a tutti gli epidemiologi. Tuttavia, nel caso di IR e salute, sono raramente applicati. Sono elencati qui nella Tabella 1.
L'applicazione generale di queste domande alla questione dell'IR e della salute è stata fatta nei rapporti del Comitato Europeo sul Rischio da Radiazioni (RCRR) [13]. Qui, il sistema sarà applicato a IR e demenza.
3.1. Collegamento indiretto attraverso l'invecchiamento
La questione del meccanismo nel caso della demenza di Alzheimers è stata rivista recentemente da Begum et al. [5] che hanno concluso che, poiché la demenza era fortemente associata all'invecchiamento, e anche l'IR era nota per aumentare il tasso di invecchiamento attraverso la generazione di specie reattive dell'ossigeno (ROS), c'era un collegamento logico tra l'esposizione all'IR e la demenza. Esistono prove significative degli effetti collaterali della radioterapia che suggeriscono che anche basse dosi di IR, come quelle delle TAC, possono innescare meccanismi associati a disfunzioni cognitive come quelle viste nell'invecchiamento normale [14] [15]. Il morbo di Alzheimer (AD), una condizione neurodegenerativa irreversibile, rappresenta fino all'80% delle demenze [16] [17]. La patologia comporta l'accumulo di placche neuritiche e di grovigli di fibre neurali (NFT). Il componente principale delle placche, un accumulo di un beta peptide amiloide derivato dalla scissione di una proteina precursore dell'amiloide (APP), è associato ad infiammazione [18] , stress ossidativo [19] [20] , formazione di NFT [21] , perdita di neuroni [22] e l'effetto complessivo è il deterioramento cognitivo legato all'AD [23]. L'idea che il ROS abbia portato alla neurodegenerazione è ormai consolidata [24]. Lo stress ossidativo produce NFT e placche neuronali, ma colpisce anche le popolazioni neuronali [25]. Elevati livelli di ROS causano danni ai componenti critici dell'integrità cellulare, DNA, RNA, proteine e lipidi [26].
Recentemente è stato trovato che l'ossidazione dell'RNA neuronale era più alta in individui che mostravano un lieve deterioramento cognitivo rispetto ai controlli di età corrispondenti. Aumentati livelli di malondialdeide (MDA), un composto prodotto dall'ossidazione di lipidi insaturi, sono stati trovati nel cervello dei pazienti con AD [27] e il trattamento con antiossidanti riduce l'incidenza di AD nei pazienti [28]. Pertanto, vi è una notevole evidenza che l'invecchiamento, causato da elevati livelli di ROS, porta alla demenza. Naturalmente, gli effetti biologici dell'IR sono principalmente attraverso la generazione di ROS [29] [30] [31]. Sono questi ioni reattivi, prodotti dall'interazione di elettroni veloci con acqua solvente e altri costituenti cellulari, che reagiscono con il DNA e producono gli effetti genetici e genomici che provocano il cancro e le altre condizioni di salute ben accettate.Dal momento che le esposizioni IR producono ROS e ROS colpisce la neurodegenerazione e la demenza, ne consegue, secondo una logica semplice, che le esposizioni IR aumenteranno i tassi di demenza attraverso questo meccanismo di invecchiamento indiretto. Ma questo può essere distinto da un effetto diretto?3.2. Effetti dell'IR sul cervello
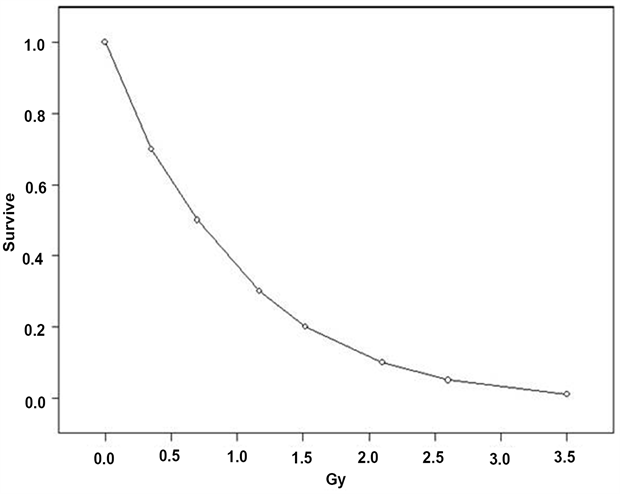
Si afferma comunemente che il cervello ha una bassa sensibilità alla radioattività. Tuttavia, non è più chiaro che questo sia il caso, ma è stata una credenza iniziale derivante dall'associazione tra il tasso di replicazione cellulare nei tessuti e la sensibilità alle radiazioni. Ci sono evidenze recenti e significative derivanti dalla ricerca sugli effetti della radioterapia del cancro, che il cervello, o alcune regioni del cervello che coinvolgono la neurogenerazione, sono in realtà altamente radio-sensibili. In primo luogo, gli effetti della IR non possono essere distinti dalla generazione di ROS. Non c'è dubbio che le cellule nervose isolate possono essere uccise da modeste dosi di IR in vitro. La Figura 1 mostra l'effetto dell'irradiazione gamma esterna delle cellule del neuroblastoma in coltura [32]. Dalla curva di sopravvivenza, il 20% di tutte le cellule viene ucciso ad una dose di circa 250 mGy e l'estrapolazione suggerirebbe che il 10% delle cellule verrebbe ucciso a 50 mGy. Questo può essere confrontato con le cellule HT29 del colon umano in coltura, dove circa 2000 mGy sono necessarie per uccidere il 20% delle cellule e le ovaie umane OVCAR 10 cellule che hanno bisogno di 1500 mGy per uccidere il 20% [32]. Ciò è dovuto al fatto che, a differenza del normale tessuto umano, che è assente l'apoptosi, le cellule del neuroblastoma umano sono dominanti nell'apoptosi; le cellule non riparano e non si replicano [32]. La perdita di neuroni nel cervello non è reversibile. L'uccisione di tutti i neuroni è la perdita di numero di neuroni in tutto il cervello. Quindi, è semplice sostenere che la morte dei neuroni e la conseguente perdita della connessione neuronale specifica nel corso della vita dell'individuo contribuirà alla perdita di memoria e cognitiva e all'aumento delle disfunzioni cerebrali. Ad esempio, dosi gamma esterne di fondo naturale di circa 0,8 mSv all'anno darebbero una dose di IR cerebrale accumulata di 48 mSv all'età di 60 anni, l'età in cui i tassi di demenza iniziano ad aumentare nelle popolazioni umane. All'età di 80 anni, dove circa 1/3 della popolazione presenta un deficit cognitivo e di memoria, la dose cumulata di IR è di circa 64 mSv e se si applicano i risultati della coltura cellulare, si ha una perdita di circa il 15-20% dei neuroni a causa della sola IR esterna. Belka 2001 afferma che l'efficacia della radioterapia è spesso limitata dalla tolleranza delle strutture del SNC [33] che è contraria a qualsiasi convinzione che il cervello sia meno radiosensibile di altri tessuti. Gli autori scrivono che le risposte cliniche alla radioterapia del cervello includono una risposta tardiva che comporta un declino diffuso della funzione cerebrale con compromissione cognitiva è il più importante [33].
La radioterapia, tuttavia, comporta dosi molto grandi, di solito decine di Gray. Un problema importante nel tentativo di valutare gli effetti IR della radioterapia a queste alte dosi è che i dati individuali e patologici sono limitati a casi con problemi clinici preesistenti ed estesi che confonderebbero qualsiasi conclusione riguardo agli effetti della IR su una popolazione sana.
Tuttavia, c'è un'altra importante componente degli effetti delle IR sul cervello. Recenti ricerche hanno identificato la capacità di ri-capacità neuronale come derivante dalle cellule neurali precursori nell'ippocampo. Questa parte del cervello produce staminali multipotenti/precursori che producono cellule che migrano via e producono neuroni o glia [34]. Una teoria è che il meccanismo cellulare e molecolare che è alla base del deterioramento cognitivo indotto dalle radiazioni comporta alterazioni nella neurogenesi dell'ippocampo [35] - [40]. I dati di pazienti umani irradiati per tumori cerebrali mostrano una riduzione delle cellule neurogeniche [40]. Studi di laboratorio indicano chiaramente che queste alterazioni della neurogenesi (e del deterioramento cognitivo) comportano un'infiammazione [18] [19] [19] [36] [36] [37] [41] [41] [42] [43] [44] [45] e fattori relativi ai livelli di ROS [42] [46].Si pone la questione della dose e del tasso di dose necessario per causare tali danni. Diversi studi hanno rilevato cambiamenti patologici e anche effetti cognitivi a varie dosi [32] [34] [35] [47]. Dosi basse possono portare a disfunzioni cognitive senza indurre effetti morfologici significativi [46]. A sostegno degli effetti sulla neurogenesi dell'ippocampo sopra descritti, i cambiamenti cognitivi prodotti dalla IR si manifestano spesso come funzioni ippocampali dipendenti dall'apprendimento, dalla memoria e dall'elaborazione spaziale delle informazioni [48] [49].
Chiaramente per valutare il rischio di causalità dell'esposizione IR, e seguendo la metodologia di Bradford Hill, l'esperimento ideale sarebbe quello di ottenere l'incidenza di demenza o la mortalità nelle popolazioni esposte a diverse dosi di IR. Questo è il metodo utilizzato per ottenere rischi di cancro e danni genetici da IR. Ci sono ovvie serie di popolazioni che possono, in linea di principio, essere studiate per ottenere informazioni sulle esposizioni alla demenza e all'IR. Queste sono:
Pazienti esposti alla radioterapia, compresa la radioterapia del cervello;
・ Hiroshima e i sopravvissuti alla bomba atomica di Nagasaki;
・ Sopravvissuti a incidenti nucleari;
・ Lavoratori nucleari;
・ Radiologi.
La radioterapia per i tumori cerebrali e altri tumori e leucemie può fornire dosi molto elevate a pazienti che hanno già dei cambiamenti nel cervello derivanti da tumori avanzati nel cervello o in altre parti del corpo. Una parte significativa dei pazienti morirà alcuni mesi o anni dopo l'esposizione alle radiazioni a causa della mancata verifica dello sviluppo del cancro. Nello studio di Tucker et al. 1989 post radiazioni di 52 individui irradiati per linfoma non Hodgkin al St Bartholomew's Hospital di Londra, solo 12 erano vivi 10 anni dopo [51]. Di conseguenza, poiché i numeri coinvolti in questi studi ospedalieri sono piccoli all'inizio, il tasso di incidenza previsto di demenza in qualsiasi gruppo di studio sarà generalmente troppo basso per aspettarsi un risultato. La tabella 2 elenca una selezione dei principali studi sulla demenza e le relative conseguenze dell'irradiazione cerebrale, i sintomi e i segni dopo la radioterapia. La maggior parte degli studi non può essere definita epidemiologica poiché l'età di ogni individuo trattato e la sua sopravvivenza dopo il trattamento non sono date se non come mezzi o mediane. Un esempio sarà sufficiente per dimostrare il problema del potere epidemiologico. Supponiamo che la radioterapia provochi un aumento di dieci volte il rischio. Prendiamo una popolazione ospedaliera di 50 pazienti in radioterapia di età compresa tra i 40 e i 50 anni. Essendo generoso, il tasso di incidenza nella popolazione normale è di 50 per 100.000. Questo è aumentato dall'esposizione a 500 ogni 100.000. Ma siccome ci sono solo 50 persone, se le seguiamo tutte per 5 anni, ci aspetteremmo solo 2500 casi su 100.000 o 0,025 di un caso anche se fossero ancora tutte vive alla fine dei 5 anni. Negli studi reali, di solito meno del 20% sopravvive per seguire i casi. Pertanto, il fatto che non ci siano stati aumenti di demenza riscontrati nella popolazione dello studio, pur essendo descrittivamente grafico, non ci dice davvero nulla sugli effetti delle esposizioni IR. Calcoli simili a quelli di altri gruppi di pazienti mostrano più o meno lo stesso problema. Pertanto, tali studi non sono utili come mezzo per quantificare gli effetti delle IR, anche se possono essere generalmente informativi. Ciò che tutti mostrano, tuttavia, sono effetti misurabili e quantificabili sia nella morfologia cerebrale che nelle valutazioni neurologiche e neuropsicologiche, che indicano chiaramente misure che sono associate alla perdita di funzione cerebrale e, in ultima analisi, alla demenza. Il problema ora non è quasi più un argomento su cui si possa discutere.
Ciò che è chiaro è che c'è solo una serie di studi epidemiologici che hanno utilizzato un approccio caso-controllo, hanno misurato o stimato dosi nella gamma di basse dosi, e che hanno avuto una popolazione abbastanza grande per disegnare conclusioni statisticamente potenti.
Questo è stato lo studio del Wilkinson 2000 del National Institute of Occupational Health (NIOSH), seguito da Sibley et al. nel 2003 e successivamente nel 2006 [57] [58] [59]. Tutti e tre gli studi hanno mostrato un effetto complessivo significativo e una tendenza altamente significativa nella risposta alla dose. Questi studi soddisfano i requisiti dei Bradford Hill Canons per la causalità e possono essere impiegati per stimare un rischio relativo di demenza da dose di radiazioni nella regione a bassa dose. Il risultato di questa operazione ha interessanti implicazioni per le popolazioni normali e viene effettuato qui di seguito.
4.2. Sopravvissuti alla bomba A
Uno dei problemi in questo caso è che i tassi di demenza aumentano a livelli che sono utili per il potere epidemiologico solo quando la popolazione ha più di 75 anni. Lo studio LSS ha individui con dosi calcolate e dati sull'età al momento dell'esposizione e i rapporti non hanno apparentemente mostrato alcun rischio significativo di eccesso di demenza correlato alla dose [63] [64] [65]. L'indagine sulla demenza è stata, tuttavia, limitata a una coorte molto più piccola (2200) di oltre 60 s reclutati nel 1950, la coorte di studio sulla salute degli adulti della Radiation Effects Research Foundation Adult Health Study, l'AHS. La conclusione è stata che non c'era nessun effetto legato alla dose di radiazioni, anche se la prevalenza nella coorte era molto più alta che in Giappone. Ciò solleva la questione della sicurezza del gruppo di controllo della LSS e degli studi sulla LSS in generale. Recentemente è stato sottolineato che la rimozione nel 1973 del gruppo di controllo non esposto, che ha definito la linea di base per gli studi sul cancro delle radiazioni, rende i risultati dell'epidemiologia della LSS non sicuri [66]. Le esposizioni a tutti e tre i "gruppi di dose" utilizzati per ottenere i coefficienti di rischio di cancro comprendevano le ricadute della "pioggia nera" post detonazione. Nel 2006 sono stati effettuati studi sui tassi di cancro utilizzando le prefetture vicine come controlli e hanno mostrato effetti significativi in tutti i gruppi di dose [67]. Ci sono altri problemi epidemiologici con lo studio LSS [13] [68].
4.3. Chernobyl
I sopravvissuti agli incidenti nucleari, in particolare l'incidente di Chernobyl, sembrano mostrare significativi effetti di deficit cognitivo in una serie di studi dell'Ucraina e della Bielorussia, ad esempio [60], ma è difficile filtrare la demenza e ancora più difficile valutare le singole dosi, che erano per lo più interne. Tuttavia, quello che possiamo dire è che le dosi interne complessive, calcolate secondo la metodologia dell'ICRP, erano tutte inferiori a 20 mSv. A queste dosi calcolate, secondo le attuali credenze scientifiche, non dovrebbero verificarsi effetti di alcun tipo. Tuttavia, questo sembra cambiare: effetti genetici negli esiti delle nascite sono stati riportati nelle aree contaminate da Chernobyl dove le dosi alle popolazioni sono state inferiori a 2 mSv, valutate in modo convenzionale. Questi risultati sollevano la questione della sicurezza della metodologia ICRP per le esposizioni interne e infatti il calcolo e la valutazione delle dosi interne di radionuclidi è attualmente un'area di dibattito [13] [30] [68]. Ciò che è richiesto in questo caso è una popolazione in cui una misura ragionevole di una dose di esposizione alle radiazioni in eccesso può essere fatta in relazione a una popolazione normale esposta solo su sfondo naturale.
5. Coorte dei lavoratori nucleari
5.1. Wilkinson et al. 2000
Wilkinson et al. 2000 [57] hanno esaminato le cause della morte di 67.976 lavoratrici dell'industria delle armi nucleari. Sebbene i tassi di mortalità standardizzati (SMR) per tutte le cause combinate siano risultati inferiori (69 per i distintivi e 78 per i non distinti) rispetto alla popolazione nazionale, l'SMR per i decessi dovuti a disturbi mentali era insolitamente alto a 147. La popolazione nazionale SMR è, naturalmente, 100. Pertanto, il rapporto di rischio per i lavoratori nucleari per i decessi per disturbi mentali era di 1,47, e avevano un rischio di morte per disturbi mentali superiore del 47% rispetto alla popolazione nazionale, anche se, a causa di un "effetto lavoratore sano", il loro rischio per tutte le cause di morte era circa il 25% inferiore. Questa scoperta inaspettata ha portato a uno studio più ampio, finanziato dal NIOSH, che ha esaminato in modo specifico i decessi per demenza. L'SMR si basava su 166 decessi per disturbi mentali, di cui 91 per demenza.
Pertanto, poiché 91 decessi rappresentano un eccesso del 47% rispetto al numero previsto in una popolazione nazionale, il numero previsto di morti per demenza in questa popolazione è di 62 (91/1.47). Mantel Haenszel Chi-quadrato = 5,49 con intervalli di confidenza del 95% di 1,06 < Odds Ratio < 2,04; p = 0,019.
5.2. Sibley et al. 2003
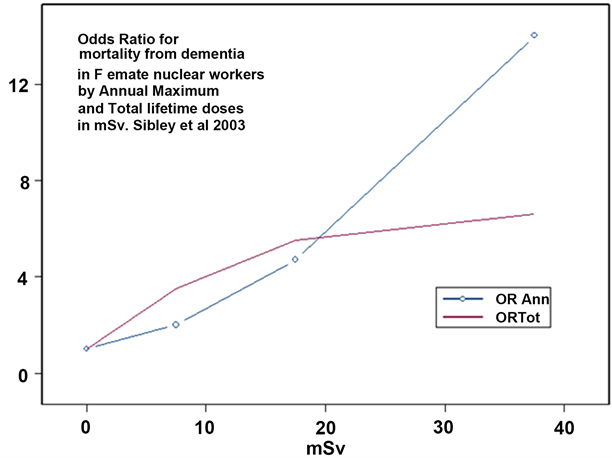
Il risultato iniziale è stato poi seguito in un ulteriore studio sulle 67.976 lavoratrici nucleari, utilizzando uno studio caso-controllo nidificante che ha esaminato i 91 decessi per demenza [58]. Poiché le stime dell'esposizione erano disponibili solo per 14 casi e 154 controlli, la metodologia si è concentrata su 14 individui che avevano misurato le dosi e confrontato le loro dosi con 154 controlli. Gli effetti delle esposizioni interne non sono stati esaminati poiché i dati non erano disponibili. Gli studi sui controlli dei casi sono generalmente accettati dagli epidemiologi come il gold standard di indagine. I risultati sono riportati nella tabella 3 e nella figura 2.
Dai dati forniti nel documento è semplice calcolare la dose media di vita ai casi come 20 mSv. Quindi, considerando l'OR complessivo come 2,23, l'ERR di rischio relativo in eccesso (come OR-1) è 1,23 per 20 mSv di dose esterna. Un'estrapolazione lineare (come quella utilizzata dall'ICRP e da altre agenzie di rischio per il cancro) dà quindi un ERR per Sievert di 1,23 × 1000/20 = 61,5.
Questo metodo è esattamente quello utilizzato per ottenere l'Excess Relative Risk for cancer and leukemia dal Odds Ratio, SMR e SIR ottenuti da studi di esposizione esterna come quello del Japanese A-Bomb Lifespan Study (LSS) [1] [10].
Gli autori di questo studio hanno ammesso che il numero di casi che hanno impiegato per lo studio di risposta alla dose era piccolo e hanno proposto di effettuare uno studio più ampio come follow-up. Questo è stato fatto e il numero è salito a 34. Lo studio è discusso di seguito. Va tenuto presente che, nel complesso, il rischio di morire di demenza era significativamente maggiore nello studio complessivo sui lavoratori nucleari di Wilkinson et al. 2000, dove ci sono stati 91 decessi, la maggior parte dei quali è stata registrata senza dosi di radiazioni. Ciò non significa, ovviamente, che non siano stati esposti né esternamente né internamente ai più alti livelli di contaminazione riscontrati nei siti di sviluppo di armi dove lavoravano. Nel calcolo attuale, le esposizioni interne devono necessariamente essere ignorate.
*Statisticamente significative al livello di p < 0,05 (95%); **al livello di p < 0,01 (99%).
5.3. Sibley et al. 2006
Dopo l'aggiustamento per l'età monitorata per la prima volta e il numero di anni monitorati, è stato osservato un rischio relativo di 1,1 (95% CI = 1,0 - 1,3) per 10 milliSieverts (mSv) per dose cumulativa. Quando sono state impiegate 3 categorie di dose cumulativa (0,0 - 9,9 mSv, 10 - 24,9 mSv e 25+ mSv, è stato osservato un Odds Ratio (OR) di 7,6 (95% CI = 2,3 - 25,0) per la categoria di dose più alta rispetto a quella più bassa. Un OR di 3,0 (95% CI = 1,3 - 7,2) per le dosi cumulative 10 - 24,9 mSv rispetto a 0,0 - 9,9 mSv è stato pure osservato.È chiaro che è stato trovato un OR altamente significativo dal punto di vista statistico di 3,0 per il test della categoria di dose da più alta a più bassa. Utilizzando lo stesso approccio, questo dà un ERR di 2.0 per 15 mSv (la differenza media tra la dose più alta e quella più bassa) o un ERR per Sievert di 133, circa il doppio di quello ottenuto dallo studio Sibley 2003. Dalla costruzione del gruppo di studio di Sibley 2006, possiamo dire che questo ERR è più grande perché è per la demenza esistente alla morte piuttosto che per la demenza come causa di morte. È quindi più vicino a una misura di incidenza piuttosto che di mortalità.
L'Excess Relative Risk (ERR) è l'eccesso di rischio riscontrato in un gruppo esposto rispetto a quello che sarebbe stato se il gruppo avesse avuto la caratteristica dei tassi di malattia della popolazione di riferimento non esposta, di solito la popolazione nazionale [10].
Se uno studio comparativo mostra un rischio relativo di RR come frazione del tasso nella popolazione di controllo di confronto (nel caso dello studio NIOSH 1,47) e l'ERR è 0,47, cioè un aumento del 47% del tasso rispetto alla popolazione di confronto, poiché l'RR nella popolazione di confronto è, naturalmente, 1,00. La derivazione di Probabilità di Causazione (PC) è un processo epidemiologico semplice e standard ed è impiegato dall'Istituto Nazionale per la Sicurezza e la Salute sul Lavoro (NIOSH) nel suo programma radioecologico IREP per determinare PC per i tumori e le leucemie indotti dalle radiazioni [10] [69]. Il processo consiste semplicemente nel decidere l'Excess Relative Risk (ERR) per Sievert per il cancro di interesse, ottenuto dall'epidemiologia dei tumori indotti dalle radiazioni, e poi nell'applicare l'equazione:
PC=(ERR)/(1+ERR) (1)
Per l'esposizione cumulativa alle radiazioni dell'individuo medio, il rischio relativo in eccesso per Sievert ottenuto dallo studio Sibley et al. 2003 sui lavoratori nucleari è 61,5.Per un fondo naturale esterno medio di 0,7 mSv/anno la dose media accumulata tra i 20 e i 65 anni è di 28 mSv e
ERR=61,5×28/1000=1,7 (2)
E la probabilità di causare la morte per demenza da radiazioni indotta da radiazioni è:
PC=1.7/2.7=0.62 (3)
Questo supporta l'ipotesi che l'esposizione alle radiazioni di fondo possa essere una delle principali cause di demenza. All'età di 80 anni la dose accumulata sarà di 42 mSv e il PC aumenta al 72%. Un aspetto interessante dell'esposizione naturale di fondo è che una componente importante di questa è costituita dal gas nobile radioattivo Radon. È un fatto interessante che il Radon, e altri gas nobili, (come il Krypron-85 emesso in quantità significative dalla fissione nucleare) hanno circa 8 volte più solubilità nei grassi chimicamente definiti che nell'acqua [70]. Così, il tessuto idrofobico come la mielina che costituisce le connessioni neurali nel cervello e in altri tessuti del sistema nervoso sarebbe previsto su base fisico-chimica per concentrare preferibilmente il Radon e altri gas nobili. Le dosi di Radon dipendono dall'ubicazione e da un'adeguata ventilazione nelle case colpite da rilasci dal terreno e da determinati materiali da costruzione.7. Discussione
La domanda che ci si pone qui è: l'esposizione alle radiazioni ionizzanti causa o contribuisce allo sviluppo della demenza? E se sì, possiamo quantificarlo in qualche modo? Sappiamo che l'esposizione alle radiazioni ionizzanti causa danni biologici e dagli studi discussi e citati sopra possiamo vedere che l'IR ha effetti profondi e oggettivamente misurabili sui tessuti e sulle funzioni cerebrali. Inoltre, il danno biologico deve influenzare il processo di invecchiamento e quindi possiamo essere sicuri che l'esposizione alle radiazioni ionizzanti aumenta il tasso di invecchiamento; infatti, sono stati citati studi che lo dimostrano. La demenza è una funzione dell'invecchiamento, che aumenta rapidamente a partire dai 65 anni.
Tornando alla questione della causalità, i requisiti di Mill e Bradford Hill possono essere applicati alle prove esaminate e discusse in questa sede.
7.1. Mill e causalità
Facendo riferimento alla Sezione 2, il Canone di accordo di Mill è soddisfatto di tutti gli studi citati. Tutti gli studi di esposizione IR discussi mostrano danni al cervello, ma in particolare gli studi di controllo dei casi della coorte Wilkinson NIOSH. Gli studi di Sibley affrontano specificamente il Canone della differenza, poiché questa è la base filosofica del metodo di studio del caso-controllo, che è progettato per confrontare direttamente le situazioni in cui l'agente causale è presente e dove è assente. Il Principio dell'accumulazione è più difficile da applicare in questo caso specificamente alla demenza, ma l'evidenza che l'IR causa una serie di malattie può essere inclusa in una discussione di questo principio. La conferma del Principio di Istanza può certamente essere applicata agli effetti generali dannosi per il cervello delle IR per le quali vi sono ora prove schiaccianti. Tuttavia, per la regione a basse dosi, abbiamo solo gli studi di coorte dei lavoratori nucleari. Per quanto riguarda la plausibilità del meccanismo, non mancano i meccanismi plausibili disponibili e discussi in precedenza per i danni cerebrali e l'eventuale demenza a seguito di esposizione agli infrarossi. Tuttavia, la questione dei diversi effetti dell'esposizione a dosi molto alte e a basse dosi sulla demenza invita ad una certa discussione. Di seguito, nella sezione 7.3.
7.2. Bradford Hill e il nesso di causa
Bradford Hill richiede che l'accertamento del nesso di causalità sia statisticamente significativo. Gli studi sui lavoratori nucleari mostrano un rischio di demenza in eccesso altamente significativo dal punto di vista statistico, inizialmente con un campione molto ampio, circa 69.000 donne e 91 decessi quando 62 sono previsti dai dati nazionali (Chi-quadrato 5,49 con intervalli di confidenza del 95% di 1,06 < Odds Ratio < 2,04; p = 0,019. Questi lavoratori avrebbero avuto una dose cumulativa media maggiore a causa delle esposizioni IR esterne ed interne e quindi non possiamo dire esattamente quali fossero le dosi medie complessive. Inoltre, si trattava di lavoratori sani: il loro CMS per tutte le cause di morte era di circa 0,7 e quindi il reale eccesso di CMS per la demenza sarebbe stato più vicino a 2. Se assumiamo una dose media di 10 mSv per l'intero gruppo, il coefficiente di rischio in eccesso (ERR) per Sievert nell'intervallo di dosi basse è di 100. La limitazione del gruppo di studio a quelli con dosi registrate comporta anche un eccesso di rischio statisticamente significativo (Tabella 3). La forza dell'associazione è sufficiente per sostenere che si tratta di un problema serio e reale. Non è possibile trovare coerenza per la demenza e l'IR in studi specifici al di là dei lavoratori nucleari. I risultati dello studio sulla bomba atomica sono sospetti a causa della rimozione del vero gruppo di controllo, ma ulteriori studi sulla demenza nelle coorti complessive della LSS potrebbero essere effettuati utilizzando le prefetture vicine. Per quanto riguarda la specificità e la reversibilità, sono accettati danni cerebrali permanenti in seguito a dosi elevate, che naturalmente non sono reversibili. Il requisito della relazione nel tempo è soddisfatto. Esiste un gradiente biologico statisticamente significativo negli studi sui lavoratori nucleari (p = 0,006). Esiste una plausibilità biologica attraverso una serie di meccanismi descritti sopra. Infine, può esserci una spiegazione alternativa? La risposta, dopo tutto quello che è stato trovato nei numerosi studi sull'IR e sul danno cerebrale, è no. Non c'è nulla che leghi gli operatori nucleari, le vittime di Chernobyl e i pazienti affetti da irradiazione cranica, se non l'IR. È giunto il momento di accettare che l'esposizione agli infrarossi aumenta l'incidenza della demenza attraverso una serie di meccanismi, e che l'effetto esiste a basse dosi di radiazioni esterne, e probabilmente anche a basse dosi di esposizioni interne.
Il modello della persistenza della memoria
L'evidenza presentata sopra dalla letteratura mostra che i cambiamenti che si verificano nel cervello che sono associati ai cambiamenti visti nella demenza possono portare a livelli di esposizione IR che sono relativamente bassi [14]. Si tratta di cambiamenti misurati dei marcatori genetici nell'ippocampo. Ma allo stesso tempo, diversi studi hanno dimostrato che le dosi estremamente elevate al cervello, in seguito alla radioterapia, sembrano indurre problemi di memoria a breve termine, ma forse non sembrano avere l'effetto proporzionato a lungo termine sulla memoria che ci si potrebbe aspettare, visti gli effetti a basse dosi. Naturalmente, come è stato sottolineato in precedenza, l'epidemiologia di coloro che sono esposti a dosi molto elevate è fortemente limitata dalla potenza statistica e dalla confusione delle cause di morte, poiché si tratta sempre di individui affetti da gravi malattie. Tuttavia, la questione degli effetti a dosi molto alte e degli effetti a basse dosi, che possono operare attraverso diversi meccanismi, è intrigante e sarà affrontata in questa sede.
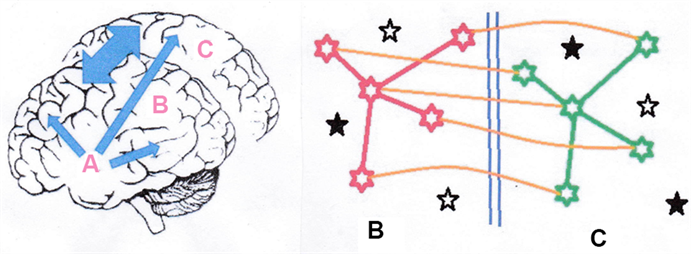
Ci sono chiaramente due componenti principali della perdita di memoria catastrofica. Una è il tasso di mortalità dei neuroni e le loro connessioni infrastrutturali. L'altra è la potenziale sostituzione dei neuroni attraverso le cellule pluripotenziali fornite dall'ippocampo. Per questo, si possono selezionare i componenti di un modello matematico e costruire un modello. Un modello di demenza che incorpora le osservazioni è delineato nella Figura 3. Si propone che la condizione derivi da una distruzione dei neuroni e della memoria associata legata all'età e alle radiazioni (non indipendente) ad un tasso che supera la sostituzione della memoria attraverso la capacità neuronale di riserva esistente e la produzione di nuova capacità neuronale attraverso l'ippocampo. Questo meccanismo e le sue equazioni cinetiche saranno presentate e più approfonditamente elaborate in un contributo separato. Tuttavia, l'approccio discorsivo di base, ignorando la variazione dei tassi cinetici, è il seguente ed è illustrato nella Figura 3.
Se il tasso uniforme di perdita dei neuroni nelle strutture di memoria dei due emisferi cerebrali è c, allora ct è il numero di neuroni persi in qualsiasi momento t dopo la nascita. Quindi lasciate che bt, allo stesso modo, rappresenti il numero di nuovi neuroni creati da cellule pluripotenziali dell'ippocampo e che sono disponibili per nuove connessioni per replicare le strutture di memoria.
Lasciate quindi che a sia il numero totale di neuroni della memoria nel cervello a t = 0.
Supponiamo che ogni struttura di memoria richieda un numero medio di N neuroni da collegare. Quindi, ci sono strutture di memoria a/N potenzialmente disponibili a t = 0.
Quindi -ct/N rappresenta la perdita di memoria, il numero di memorie per unità di tempo.
bt/N rappresenta la potenziale copiatura delle memorie su nuovi neuroni forniti dall'ippocampo e quindi il recupero delle memorie attraverso questo meccanismo.
Poi l'insorgenza della demenza si verifica quando non c'è più capacità. Questo avviene al momento T quando la capacità di memoria complessiva è sopraffatta:
Chiaramente questo sarà influenzato da (T cambierà):
a) La dimensione del cervello per iniziare con t = 0 (genetica, capacità cranica, volume della testa); N Il numero di memorie utilizzate o richieste (intellettuali vs. agricoltori).
b) L'efficienza e lo sviluppo dell'ippocampo (stress, radiazioni, ROS, genetica).
c) Il tasso di danno o di morte della popolazione neuronale (radiazioni, ROS, traumi).Il modello presentato in Figura 3 presuppone che la memoria sia condivisa tra i due emisferi, e che la ragione dello sviluppo evolutivo dei due emisferi è che la memoria è immagazzinata come matrice di connessioni tra neuroni. In un sistema come il cervello, dove, a differenza di altri organi del corpo, le cellule non si riparano e non si replicano per sostenere l'integrità dei tessuti, non sono le singole cellule ad essere importanti, ma il sistema di interconnessione dei neuroni che è importante; sono le connessioni che rappresentano le strutture della memoria (Figura 3). Chiaramente, quindi, come per il sistema coniugato a doppia elica si è evoluto per mantenere l'integrità delle informazioni sul DNA, ci deve essere una copia fatta dal cervello da qualche parte che può essere utilizzata per mantenere la persistenza della memoria. Questo deve essere il sistema a specchio a 2 emisferi. Poi, quando parte di una specifica memoria viene distrutta in un emisfero, quella memoria può essere reinserita da qualche parte nello stesso emisfero attraverso nuove connessioni fatte dall'emisfero coniugato. Questo spiega l'osservazione sconcertante del recupero della memoria dopo un trauma massivo. Finché nell'emisfero non traumatizzato rimangono sufficienti componenti della memoria, o anche in parti dei due emisferi, la memoria sarà ricostruibile, persisterà e nel tempo si recupererà attraverso la copia di ritorno dall'emisfero o dagli emisferi non danneggiati. In effetti, la perdita temporanea di memoria che si recupera in pochi mesi si vede in coloro che sono stati esposti a dosi di radiazioni molto elevate. Inoltre, in un sistema dove sono le connessioni piuttosto che i neuroni a definire la memoria e dove i neuroni non si dividono (e in effetti non avrebbe senso) c'è la necessità di produrre nuovi neuroni, e sembra che un tale sistema esista nell'ippocampo.
La possibilità di questa riparazione della memoria presupporrà che ci sia una capacità neuronale di riserva e questo solleva la questione di tale capacità. Nel modello si suppone che ci sia un numero di neuroni di base, di solito molto di più (si suppone) di quanto sarà necessario in una vita media, anche se questo può distinguere tra coloro che richiedono grandi quantità di memoria (ad esempio gli intellettuali) e quelli che non ne hanno bisogno (ad esempio gli agricoltori). Inoltre, c'è il sistema di sostituzione attraverso l'attività dell'ippocampo, che probabilmente sarà regolato in qualche modo. Il fallimento della memoria si verifica, come si vede in Equazione (4), quando la capacità totale della memoria disponibile diventa zero come risultato di una combinazione di distruzione neuronale dovuta all'invecchiamento e quindi alla radiazione, con una produzione insufficiente o nulla di nuovi neuroni dall'ippocampo.
Sono stati misurati gli effetti di basse dosi di IR sull'ippocampo: essi sono mediati non dal danno, ma dall'alterazione indotta dell'attività [14]. Questi cambiamenti devono essere normativi e il loro scopo non è chiaro. Tuttavia, si vedono, e hanno caratteristiche simili ai cambiamenti osservati nei pazienti affetti da demenza, ed è quindi facile sostenere che sono associati ad una riduzione della produzione delle cellule pluripotenziali necessarie a compensare il tasso di perdita della memoria neuronale.
8. Conclusione
Riconoscimenti
Sono grato per il famoso e strano dipinto surrealista del defunto Salvador Dalì, intitolato "La persistenza della memoria", che ho rubato per il modello di demenza che ho proposto e che svilupperò più pienamente in un contributo separato. È interessante notare che il pesce centrale come oggetto che scade sulla spiaggia nel dipinto di Dalì potrebbe benissimo essere preso come una rappresentazione onirica del povero piccolo ippocampo, l'eroe di questa storia della memoria e sembra sempre più il nostro equilibrio mentale. Sono grato al dottor Fred Mettler per aver attirato la mia attenzione su questo tema, e in particolare per le testimonianze di studi di radioterapia ad altissimo dosaggio, che mi hanno messo sulla strada dell'esame di questi interessanti e importanti temi.
Abbreviazioni
AD: Malattia di Alzheimer.
AHS: Coorte di studio giapponese sulla salute degli adulti con la bomba atomica.
APP: Proteina precursore dell'amiloide.
BEIR: Comitato per gli effetti biologici delle radiazioni ionizzanti dell'Accademia Nazionale delle Scienze degli Stati Uniti.
CAT: Tomografia assiale computerizzata.
DNA: Acido desossiribonucleico.
ECRR: Comitato europeo per il rischio da radiazioni.
ERR: Excess Relative Risk: è 1+RRR e rappresenta l'eccesso di rischio frazionario nel gruppo di studio che può essere attribuito all'esposizione ricevuta dal gruppo di studio.
ICRP: Commissione Internazionale per la Protezione Radiologica.
IR: Radiazioni ionizzanti.
IREP: Probabilità epidemiologica delle radiazioni ionizzanti.
LNT: Lineare senza soglia. La funzione convenzionale di risposta alla dose presunta per gli effetti sulla salute delle radiazioni ionizzanti.
LSS: Life Span Study of the effects of radiation on the Japanese A-Bomb coorts in Hiroshima and Nagasaki.
MDA: Malondialdeide.
NFT: Grovigli di Fibra Neurale.
NIOSH: Istituto nazionale per la sicurezza e la salute sul lavoro.
OR: Odds Ratio: il rapporto tra il tasso di malattia tra due popolazioni abbinate.
PC: Probabilità di Causazione: la probabilità frazionaria che la malattia o la condizione per la quale è stato ottenuto un RR da uno studio sia stata causata da una specifica esposizione numerica. PC = ERR/(1+ERR); a volte anche espressa in percentuale.
RNA: Acido ribonucleico.
ROS: Specie reattive dell'ossigeno: i frammenti altamente reattivi dell'acqua e di altri materiali nel corpo causati da radiazioni ionizzanti, ma anche come intermedi in alcune reazioni chimiche.
RR: Rischio relativo: il rapporto tra il tasso di malattia regolato in base all'età e al sesso in un gruppo di studio rispetto a quello della popolazione, compresi i membri del gruppo di studio.
SMR: Rapporto di mortalità standardizzato; il tasso di mortalità rispetto al tasso di popolazione nazionale.
Conflitti di interesse
Gli autori non dichiarano alcun conflitto di interessi.
Referenze
| [1] | ICRP (2007) The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103. Annals of the ICRP, 37, 1-332. |
| [2] |
Richardson, R.B. (2009) Ionizing Radiation and Aging: Rejuvenating an Old Idea. Aging, 1, 887-902. https://doi.org/10.18632/aging.100081 |
| [3] |
Hebert, L.E., Scherr, P.A., Bienias, J.L., et al. (2003) Alzheimer
Disease in the US Population: Prevalence Estimates Using the 2000
Census. Archives of Neurology, 60, 1119-1122. https://doi.org/10.1001/archneur.60.8.1119 |
| [4] |
Becker, N., Liebermann, D., Wesch, H., et al. (2008) Mortality among
Thorotrast-Exposed Patients and an Unexposed Comparison Group in the
German Thorotrast Study. European Journal of Cancer, 44, 1259-1268. https://doi.org/10.1016/j.ejca.2008.02.050 |
| [5] |
Begum, N., Wang, B., Mori, M. and Vares, G. (2012) Does Ionizing
Radiation Influence Alzheimer’s Disease Risk? Journal of Radiation
Research, 53, 815-822. https://doi.org/10.1093/jrr/rrs036 |
| [6] |
Asai, A., Matsutani, M., Kohno, T., et al. (1989) Subacute Brain Atrophy
after Radiation Therapy for Malignant Brain Tumor. Cancer, 63,
1962-1974. https://doi.org/10.1002/1097- 0142(19890515)63:10<1962::AID-CNCR2820631016>3.0.CO;2-V |
| [7] |
Imperato, J.P., Paleologos, N.A. and Vick, N.A. (1990) Effects of
Treatment on Long-Term Survivors with Malignant Astrocytomas. Annals of
Neurology, 28, 818-822. https://doi.org/10.1002/ana.410280614 |
| [8] | Mill, J.S. (1879) A System of Logic. Longmans, Green & Co., London. |
| [9] | Bradford Hill, A. (1966) Principles of Medical Statistics. The Lancet Limited, London. |
| [10] | BEIR VII (2007) The Health Risks of Exposure to Low Levels of Ionizing Radiation. National Academy of Sciences, Washington DC. |
| [11] |
Cardis, E., Vrijheid, M., Blettner, M., et al. (2007) The 15-Country
Collaborative Study of Cancer Risk among Radiation Workers in the
Nuclear Industry: Estimates of Radiation-Related Cancer Risks. Radiation
Research, 167, 396-416. https://doi.org/10.1667/RR0553.1 |
| [12] | Harre, R. (1985) The Philosophies of Science. Oxford University Press, Oxford. |
| [13] | Busby, C., Yablolov, A.V., Schmitz Feuerhake, I., Bertell, R. and Scott Cato, M. (2010) ECRR 2010: The 2010 Recommendations of the European Committee on Radiation Risk. Gli effetti sulla salute dell'esposizione a basse dosi di radiazioni ionizzanti . ECRR, Brussels. |
| [14] |
Lowe, X.R., Bhattacharya, S., Marchetti, F., et al. (2009) Early Brain
Response to Low-Dose Radiation Exposure Involves Molecular Networks and
Pathways Associated with Cognitive Functions, Advanced Aging and
Alzheimer’s Disease. Radiation Research, 171, 53-65. https://doi.org/10.1667/RR1389.1 |
| [15] | Kempf. S.J., Janik, D., Barjaktarovic, Z., Braga-Tanaka III, I., Tanaka, S., Neff, F., Saran, A., Larsen. M.R. and Tapio, S. (2016) Chronic Low-Dose-Rate Ionising Radiation Affects the Hippocampal Phosphoproteome in the ApoE-/- Alzheimer’s Mouse Model. Oncotarget, 7, 71817-71832. |
| [16] |
Demarin, V., Zavoreo, I., Kes, V.B., et al. (2011) Biomarkers in
Alzheimer’s Disease. Clinical Chemistry and Laboratory Medicine, 49,
773-778. https://doi.org/10.1515/CCLM.2011.139 |
| [17] |
Schaeffer, E.L., Figueiro, M. and Gattaz, W.F. (2011) Insights into
Alzheimer Disease Pathogenesis from Studies in Transgenic Animal Models.
Clinics, 66, 45-54. https://doi.org/10.1590/S1807-59322011001300006 |
| [18] |
Wyss-Coray, T. and Rogers, J. (2012) Inflammation in Alzheimer Disease—A
Brief Review of the Basic Science and Clinical Literature. Cold Spring
Harbor Perspectives in Medicine, 2, a006346. https://doi.org/10.1101/cshperspect.a006346 |
| [19] |
Nunomura, A., Perry, G., Aliev, G., et al. (2001) Oxidative Damage Is
the Earliest Event in Alzheimer Disease. Journal of Neuropathology &
Experimental Neurology, 60, 759-767. https://doi.org/10.1093/jnen/60.8.759 |
| [20] |
Smith, M.A., Hirai, K., Hsiao, K., et al. (1998) Amyloid-β Deposition in
Alzheimer Transgenic Mice Is Associated with Oxidative Stress. Journal
of Neurochemistry, 70, 2212-2215. https://doi.org/10.1046/j.1471-4159.1998.70052212.x |
| [21] |
Jucker, M. and Walker, L.C. (2011) Pathogenic Protein Seeding in
Alzheimer Disease and Other Neurodegenerative Disorders. Annals of
Neurology, 70, 532-540. https://doi.org/10.1002/ana.22615 |
| [22] |
Calissano, P., Matrone, C. and Amadoro, G. (2009) Apoptosis and in Vitro
Alzheimer’s Disease Neuronal Models. Communicative & Integrative
Biology, 2, 163-169. https://doi.org/10.4161/cib.7704 |
| [23] |
Patrias, L.M., Klaver, A.C., Coffey, M.P., et al. (2011) Effects of
External Beam Radiation on in Vitro Formation of Abeta1-42 Fibrils and
Preformed Fibrils. Radiation Research, 175, 375-381. https://doi.org/10.1667/RR2448.1 |
| [24] |
Valko, M., Leibfritz, D., Moncol, J., et al. (2007) Free Radicals and
Antioxidants in Normal Physiological Functions and Human Disease. The
International Journal of Biochemistry & Cell Biology, 39, 44-84. https://doi.org/10.1016/j.biocel.2006.07.001 |
| [25] |
Hirai, K., Aliev, G., Nunomura, A., et al. (2001) Mitochondrial
Abnormalities in Alzheimer’s Disease. Journal of Neuroscience, 21,
3017-3023. https://doi.org/10.1523/JNEUROSCI.21-09-03017.2001 |
| [26] |
Markesbery, W.R. and Lovell, M.A. (2007) Damage to Lipids, Proteins,
DNA, and RNA in Mild Cognitive Impairment. Archives of Neurology, 64,
954-956. https://doi.org/10.1001/archneur.64.7.954 |
| [27] |
Dalle-Donne, I., Rossi, R., Colombo, R., et al. (2006) Biomarkers of
Oxidative Damage in Human Disease. Clinical Chemistry, 52, 601-623. https://doi.org/10.1373/clinchem.2005.061408 |
| [28] |
Mancuso, C., Bates, T.E., Butterfield, D.A., et al. (2007) Natural
Antioxidants in Alzheimer’s Disease. Expert Opinion on Investigational
Drugs, 16, 1921-1931. https://doi.org/10.1517/13543784.16.12.1921 |
| [29] | BEIR V (1990) The Health Effects of Exposure to Low Levels of Ionising Radiation. Committee on Biological Effects of Ionising Radiation, National Academy Press, Washington DC. |
| [30] |
Busby, C. (2013) Aspects of DNA Damage from Internal Radionuclides. In:
Chen, C., Ed., New Research Directions in DNA Repair, IntechOpen,
597-637. http://www.intechopen.com/books/new-research-directions-in-dna-repair/aspects-of-dna-damage-from-internal-radionuclides https://doi.org/10.5772/53942 |
| [31] | UNSCEAR (2000) Sources and Effects of Ionising Radiation, Report to the General Assembly, with Scientific Annexes. United Nations, New York. |
| [32] | Hall Eric, J. (2006) Radiobiology for the Radiologist. Lippincott, Philadelphia. |
| [33] |
Belka, C., Budach, W., Kortmann, R.D., et al. (2001) Radiation Induced
CNS Toxicity—Molecular and Cellular Mechanisms. British Journal of
Cancer, 85, 1233-1239. https://doi.org/10.1054/bjoc.2001.2100 |
| [34] |
Fike, J.R., Rosi, S. and Limoli, C.L. (2009) Neural Precursor Cells and
Radiation Sensitivity. Seminars in Radiation Oncology, 19, 122-132. https://doi.org/10.1016/j.semradonc.2008.12.003 |
| [35] |
Raber, J., Fan, Y., Matsumori, Y., Liu, Z., Weinstein, P.R., Fike, J.R.
and Liu, J. (2004) Irradiation Attenuates Neurogenesis and Exacerbates
Ischemia-Induced Deficits. Annals of Neurology, 55, 381-389. https://doi.org/10.1002/ana.10853 |
| [36] |
Raber, J., Rola, R., LeFevour, A., Morhardt, D.R., Curley, J.,
Mizumatsu, S., VandenBerg, S.R. and Fike, JR. (2004) Radiation-Induced
Cognitive Impairments Are Associated with Changes in Indicators of
Hippocampal Neurogenesis. Radiation Research, 162, 39-47. https://doi.org/10.1667/RR3206 |
| [37] | Rola, R., Raber, J., Rizk, A., Otsuka, S., VandenBerg, S.R., Morhardt, D.R. and Fike, J.R. (2004) Radiation-Induced Impairment of Hippocampal Neurogenesis Is Associated with Cognitive Deficits in Young Mice. Experimental Neurology, 188, 316-330. |
| [38] | Madsen, T.M., Kristjansen, P.E., Bolwig, T.G. and Wortwein, G. (2003) Arrested Neuronal Proliferation and Impaired Hippocampal Function Following Fractionated Brain Irradiation in the Adult Rat. Neuroscience, 119, 635-642. |
| [39] |
Winocur, G., Wojtowicz, J.M., Sekeres, M., Snyder, J.S. and Wang, S.
(2006) Inhibition of Neurogenesis Interferes with Hippocampus-Dependent
Memory Function. Hippocampus 16, 296-304. https://doi.org/10.1002/hipo.20163 |
| [40] |
Gage, F.H. (2000) Mammalian Neural Stem Cells. Science, 287, 1433-1438. https://doi.org/10.1126/science.287.5457.1433 |
| [41] |
Monje, M.L., Vogel, H., Masek, M., Ligon, K.L., Fisher, P.G. and Palmer,
T.D. (2007) Impaired Human Hippocampal Neurogenesis after Treatment for
Central Nervous System Malignancies. Annals of Neurology, 62, 515-250. https://doi.org/10.1002/ana.21214 |
| [42] |
Fike, J.R., Rola, R. and Limoli, C.L. (2007) Radiation Response of
Neural Precursor Cells. Neurosurgery Clinics of North America, 18,
115-127. https://doi.org/10.1016/j.nec.2006.10.010 |
| [43] | Mizumatsu, S., Monje, M.L., Morhardt, D.R., Rola, R., Palmer, T.D. and Fike, J.R. (2003) Extreme Sensitivity of Adult Neurogenesis to Low Doses of X-Irradiation. Cancer Research, 63, 4021-4027. |
| [44] |
Monje, M.L., Mizumatsu, S., Fike, J.R. and Palmer, T.D. (2002)
Irradiation Induces Neural Precursor-Cell Dysfunction. Nature Medicine,
8, 955-962. https://doi.org/10.1038/nm749 |
| [45] |
Monje, M.L., Toda, H. and Palmer, T.D. (2003) Inflammatory Blockade
Restores Adult Hippocampal Neurogenesis. Science, 302, 1760-1765. https://doi.org/10.1126/science.1088417 |
| [46] |
Giedzinski, E., Rola, R., Fike, J.R. and Limoli, C.L. (2005) Efficient
Production of Reactive Oxygen Species in Neural Precursor Cells after
Exposure to 250 MeV Protons. Radiation Research, 164, 540-544. https://doi.org/10.1667/RR3369.1 |
| [47] |
Rola, R., Zou, Z., Huang, T.-T., Fishman, K., Baure, J., Rosi, S.,
Milliken, H., Limoli, C.L. and Fike, J.R. (2007) Lack of Extracellular
Superoxide Dismutase (EC-SOD) in the Microenvironment Impacts
Radiation-Induced Changes in Neurogenesis. Free Radical Biology and
Medicine, 42, 1133-1145. https://doi.org/10.1016/j.freeradbiomed.2007.01.020 |
| [48] |
Schultheiss, T.E., Kun, L.E., Ang, K.K., et al. (1995) Radiation
Response of the Central Nervous System. International Journal of
Radiation Oncology, Biology, Physics, 31, 1093-1112. https://doi.org/10.1016/0360-3016(94)00655-5 |
| [49] | Raber, J. (2010) Unintended Effects of Cranial Irradiation on Cognitive Function. Toxicologic Pathology, 38, 198-202. |
| [50] | Prince, M., Albanese, E., Guerchet, M. and Prina, M. (2014) World Alzheimer Report 2014. Dementia and Risk Reduction. Alzheimers Disease International, London. |
| [51] |
Tucker, J., Prior, P.F., Green, C.R., et al. (1989) Minimal
Neuropsychological Sequelae Following Prophylactic Treatment of the
Central Nervous System in Adult Leukemia and Lymphoma. British Journal
of Cancer, 60, 775-780. https://doi.org/10.1038/bjc.1989.358 |
| [52] |
Grosshans, D.R., Meyers, C.A., Allen, P.K., et al. (2008) Neurocognitive
Function in Patients with Small Cell Lung Cancer. Effect of
Prophylactic Cranial Irradiation. Cancer, 112, 589-595. https://doi.org/10.1002/cncr.23222 |
| [53] |
Peper, M., Steinvorth, S., Schraube, P., et al. (2000) Neurobehavioral
Toxicity of Total Body Irradiation: A Follow-Up in Long-Term Survivors.
International Journal of Radiation Oncology, Biology, Physics, 46,
303-311. https://doi.org/10.1016/S0360-3016(99)00442-3 |
| [54] |
Neider, C., Leicht, A., Motaref, B., et al. (1999) Late Radiation
Toxicity after Whole Brain Radiotherapy: The Influence of Antiepileptic
Drugs. American Journal of Clinical Oncology: Cancer Clinical Trials,
22, 573-579. https://doi.org/10.1097/00000421-199912000-00007 |
| [55] |
Frytak, S., Shaw, J.N., O’Neill, B.P., et al. (1989) Leukencephalopathy
in Small Cell Lung Cancer Patients Receiving Prophylactic Cranial
Irradiation. American Journal of Clinical Oncology, 12, 27-33. https://doi.org/10.1097/00000421-198902000-00007 |
| [56] |
Schulte, P.A., Burnett, C.A., Boeniger, M.S. and Johnson, J. (1996)
Neurodegenerative Diseases: Occupational Occurrence and Potential Risk
Factors, 1982 through 1991. American Journal of Public Health, 86,
1281-1288. https://doi.org/10.2105/AJPH.86.9.1281 |
| [57] | Wilkinson, G.S., Trieff, N., Graham, R. and Proire, R.L. (2000) Study of Mortality among Female Nuclear Weapons Workers. NIOSH, Washington DC. |
| [58] |
Sibley, R.F., Moscato, B.S., Wilkinson, G.S. and Natarajan, N. (2003)
Nested Case-Control Study of External Ionizing Radiation Dose and
Mortality from Dementia within a Pooled Cohort of Female Nuclear Weapons
Workers. American Journal of Industrial Medicine, 44, 351-538. https://doi.org/10.1002/ajim.10288 |
| [59] |
Sibley, R., Wilkinson, G. and Servoss, T. (2006) A Case Control Study of
Dementia in Female Nuclear Workers. Epidemiology, 17, S521. https://doi.org/10.1097/00001648-200611001-01402 |
| [60] |
Loganovsky, K. (2009) Do Low Doses of Ionizing Radiation Affect the Human Brain? Data Science Journal, 8, BR13-BR35. https://www.researchgate.net/publication/ 220390293_Do_Low_Doses_of_Ionizing_Radiation_Affect_the_Human_Brain https://doi.org/10.2481/dsj.br-04 |
| [61] |
Johnson, B.E., Becker, B., Goff, W.B., et al. (1985) Neurologic,
Neuropsychologic and Computed Cranial Tomography Scan Abnormalities in
2- to 10-Year Survivors of Small-Cell Lung Cancer. Journal of Clinical
Oncology, 3, 1659-1667. https://doi.org/10.1200/JCO.1985.3.12.1659 |
| [62] | Marazziti, D., Baroni, S., Lombardi, A., et al. (2014) Psychiatric Effects of Ionizing Radiation. The Clinical Neuropsychologist, 11, 61-67. |
| [63] |
Preston, D.L., Shimizu, Y., Pierce, D.A., et al. (2003) Studies of
Mortality of Atomic Bomb Survivors. Report 13: Solid Cancer and
Noncancer Disease Mortality: 1950-1997. Radiation Research, 160,
381-407. https://doi.org/10.1667/RR3049 |
| [64] |
Little, M.P. (2009) Cancer and Non-Cancer Effects in Japanese Atomic
Bomb Survivors. Journal of Radiological Protection, 29, A43-A59. https://doi.org/10.1088/0952-4746/29/2A/S04 |
| [65] |
Yamada, M., Sasaki, H., Mimori, Y., et al. (1999) Prevalence and Risks
of Dementia in the Japanese Population: RERF’s Adult Health Study
Hiroshima Subjects. Radiation Effects Research Foundation. Journal of
the American Geriatrics Society, 47, 189-195. https://doi.org/10.1111/j.1532-5415.1999.tb04577.x |
| [66] |
Busby, C. (2016) Letter to the Editor on “The Hiroshima/Nagasaki
Survivor Studies: Discrepancies between Results and General Perception”
by Bernard R Jordan. Genetics, 204, 1627-1629. https://doi.org/10.1534/genetics.116.195339 |
| [67] |
Wanatabe, T., Miyao, M., Honda, R. and Yamada, Y. (2008) Hiroshima
Survivors Exposed to Very Low Doses of A-Bomb Primary Radiation Showed a
High Risk of Cancers. Environmental Health and Preventive Medicine, 13,
264-270. https://doi.org/10.1007/s12199-008-0039-8 |
| [68] | Schmitz-Feuerhake, I., Busby, C. and Pflugbeil, P. (2016) Genetic Radiation Risk: A Neglected Topic in the Low Dose Debate. Environmental Health and Toxicology, 31, e2016001. |
| [69] |
Centre for Disease Control CDC (2014) NIOSH Radiation Dose Reconstruction: Probability of Causation. Atlanta. http://www.cdc.gov/niosh/ocas/pccalc.html |
| [70] | Clever, H.L. (1979) Krypton, Xenon and Radon. IUPAC Solubility Series, Vol. 2, Pergamon Press, Oxford. |





Nessun commento:
Posta un commento